

株式会社NPT
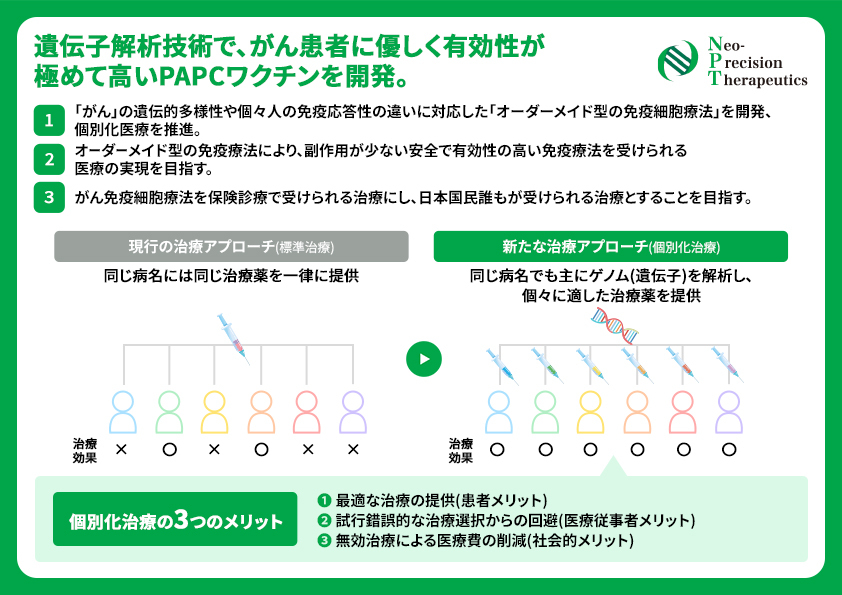
●「がん」の遺伝的多様性や個々人の免疫応答性の違いに対応した「オーダーメイド型の免疫細胞療法」を開発、個別化医療を推進。
●オーダーメイド型の免疫療法により、副作用が少ない安全で有効性の高い免疫療法を受けられる医療の実現を目指す。
●がん免疫細胞療法を保険診療で受けられる治療にし、日本国民誰もが受けられる治療とすることを目指す。
▼解決する課題
日本では「がん」で亡くなる方の数は増加の一途を辿り、現行の薬物療法(抗がん剤・分子標的薬・免疫チェックポイント阻害剤等)による治療限界が浮き彫りになっています。
「がん」の原因は遺伝子変異によって起こるとされています。現行の画一的な治療アプローチは「がん」の遺伝的多様性や個々人の免疫応答性の違いに対応していないため、その効果には限界があり、またその副作用は患者に多大なダメージを与えます。
そこで、当社では患者一人ひとりの状態に応じた「オーダーメイド型の免疫細胞療法」というこれまでの治療概念を覆す新たな治療法を開発し、一人ひとりが安全でより有効な免疫細胞治療を受けられる医療を実現します。
▼解決する方法
当社が開発に成功したPAPCワクチンの特徴は、患者一人ひとりのがん遺伝情報を解析し、その人のがん細胞にしか存在しない「ネオ抗原」を標的とした完全オーダーメイド型の免疫細胞療法です。
ネオ抗原を人工的に合成し、その患者の白血球から作製した「抗原提示細胞(樹状細胞)」という細胞に載せて体に戻す治療法です。
従来のがん免疫細胞療法とは異なり、その患者個人に特化した安全で有効な個別化治療を提供することが可能になります。
▼ビジネスモデル
当社自らが治験(薬機法に基づき保険適用を受けるための臨床試験)を行い、再生医療等製品の早期承認制度を活用し薬事承認を受けた後は保険適用の治療薬として上市し、医療現場で標準的治療として展開していきます。自ら製薬会社となり自社製造・販売を行います(ただし、製造はCDMO(医薬品開発製造受託機関)に委託します)。
▼マーケット
PAPCワクチンの対象患者は公的医療保険を受けている方で、現行の標準的治療が終わった方です。食道がんと診断される患者数は年間約30,000人超ですが、このうち約1割(約3,100人程)が治療対象になります。また、このワクチン製造技術は他のがん種への適応拡大が可能で、胃がんや頭頸部がんをはじめとする多くの固形がんに利用することができます。
*公的医療保険を受けている方:保険適用の治療となるので高額療養費制度も活用可能です。
▼成長計画と戦略
薬機法上、医師は治療戦略の1つとして患者に提示する義務を負い、患者はこの治療法を必ず知ることになります。また、患者にとっては公的医療保険の適用となるので選択の障害はありません。(広告宣伝不要)
私どもの調査では、食道がん患者の多くは南関東エリア(東京都・神奈川県・埼玉県・千葉県)を含む地方の大都市の病院に入院・来院していることが分かっています。特に南関東エリアの病院には市場規模の約7割(約2,100人)の患者がいることを確認しています。先ずはこのエリア中心に医療機関との契約・販売網を作り治療実績を積み重ね、地方の基幹病院へと販売網を広げます。
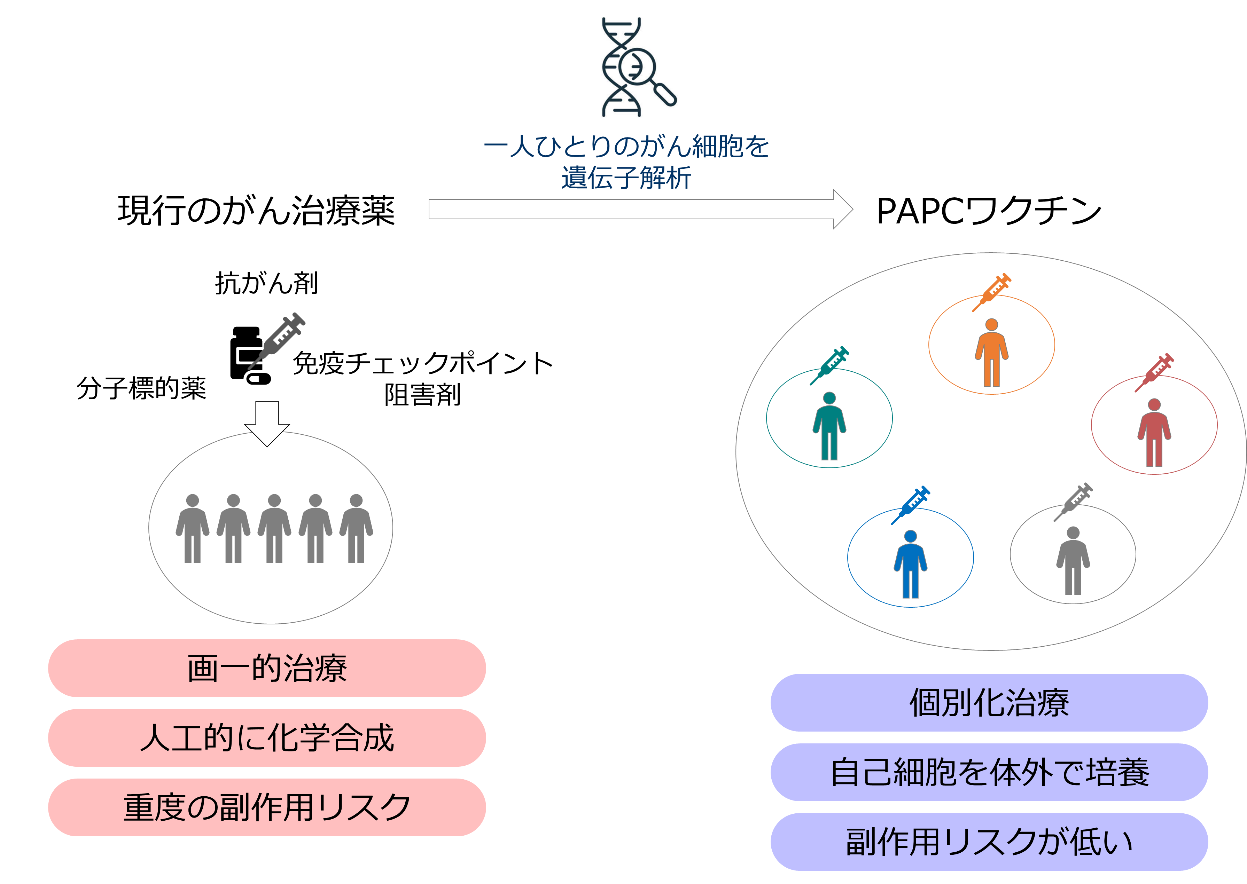
現行の最も一般的な治療法として抗がん剤がありますが、がん細胞のみならず正常な細胞にもダメージを与えてしまうため、副作用の出現といった安全面に課題があります。また、その有効性は患者の体力、免疫力とのバランスによるところがあります。
一方、近年の遺伝子解析技術によって一人ひとりのがん細胞にはその人にしか存在しない「ネオ抗原」の存在が明らかになりました。ネオ抗原は、正常細胞には存在しない抗原で、ネオ抗原を標的とした治療は正常細胞にダメージを与えることなく、がん細胞をピンポイントに攻撃することが可能になります。当社は、このネオ抗原を標的とした自己の免疫細胞を利用した高い安全性と有効性が期待される「PAPCワクチン」を開発しました。
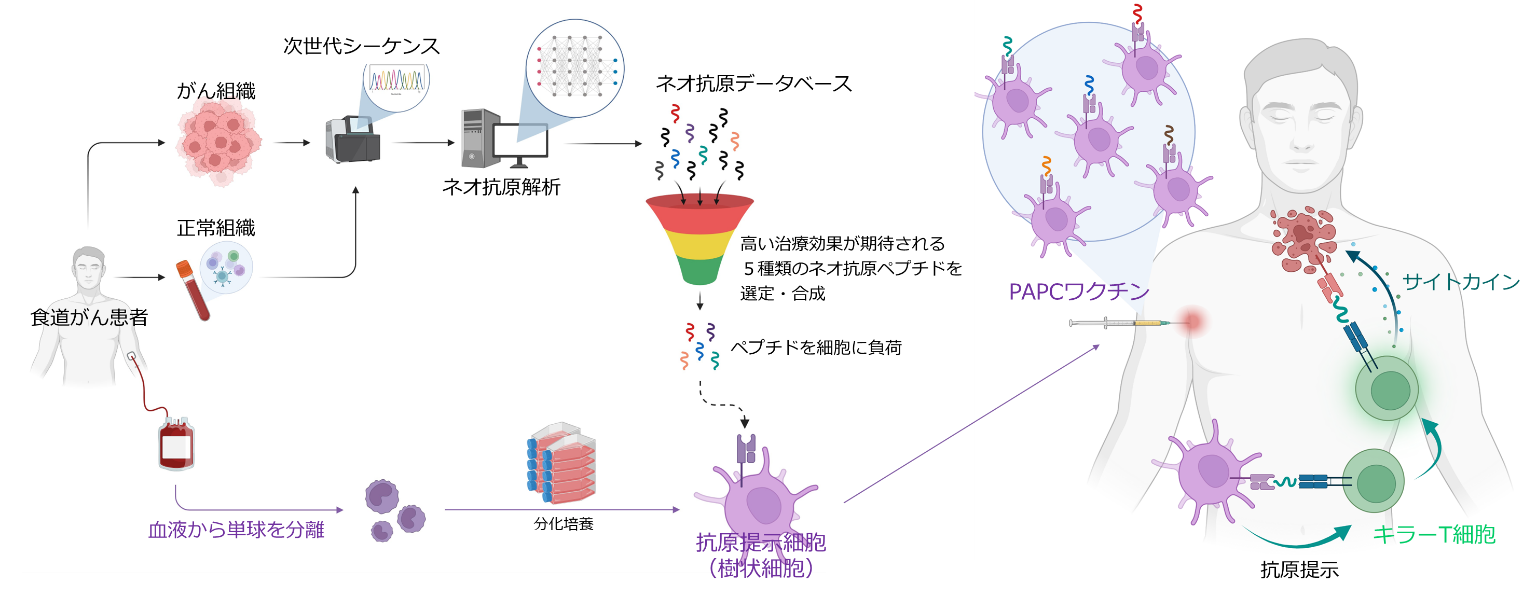
がん患者から得られたがん及び正常組織を基に次世代シーケンスとネオ抗原解析を行い、がん細胞に特異的に発現する変異遺伝子(ネオ抗原)を同定します。続いて、同定されたネオ抗原の中からキラーT細胞が反応し易い5種類のネオ抗原を絞り込みペプチドとして合成します。その後、同一患者由来の単球を体外で抗原提示細胞(樹状細胞)へと変化させ、これに5種類のネオ抗原ペプチドを載せた抗原提示細胞の製品が「PAPCワクチン」です。患者に皮内投与したPAPCワクチンはキラーT細胞にネオ抗原ペプチドの情報を伝達し、活性化した(増殖し、元気になった)キラーT細胞は同じネオ抗原ペプチドをもっているがん細胞を見つけると攻撃を開始し、がん細胞を破壊します。ネオ抗原ペプチドを直接体内に投与するよりも抗原提示細胞に載せた状態で投与することで、効率的にキラーT細胞を活性化できるのが特徴です。また、ネオ抗原の種類は一人ひとりの患者で異なるため、その人に適した完全オーダーメイドの治療を提供することが可能になります。
このようなネオ抗原を標的としたオーダーメイド治療薬は世界で盛んに開発されていますが、それら競合品の多くはネオ抗原そのものをmRNA又はペプチドのかたちで直接体に投与し、体の中にいる抗原提示細胞に届けるというアプローチです。これに対して、当社は体の外で作製した抗原提示細胞にネオ抗原を載せて体に投与するというアプローチをとっています。前者の場合、ネオ抗原が体内の抗原提示細胞に届けられるか、届いたとしても正確に抗原提示できるかといった不確定要素があります。当社のアプローチは、体外で抗原提示細胞を作り、それにネオ抗原を確実に載せて体に投与します。その抗原提示細胞自体も体内にいる抗原提示細胞とは比較できないほど品質が高く、これを多量に体に投与することでキラーT細胞を活性化する能力は遥かに高いと予想されます。

出典:Gerald PL, et al. Trends Mol Med. 2017 より当社改訂
当社自らが製造及び販売を行います。PAPCワクチンの製造はCDMO(医薬品開発製造受託機関)に業務委託し、当社は品質保証業務と販売業務を担います。

患者が免疫細胞療法を受ける方法は、①保険診療と、②自由診療の2つあります。
①の保険診療は公的医療保険に加入している方であれば、国が治療費を負担し、最大3割が自己負担分となります。また、保険適用された治療を受ける場合は高額療養費制度を活用することができます。これにより高額な治療費の自己負担が必要になった場合でも、数万円~十数万円の自己負担で済むというメリットがあります。そして、保険適用の対象となる免疫細胞療法になるためには、「薬機法」という法律に準拠した厳しい基準をクリアしなければなりません。
その一方、②の自由診療とは治療費の全額を患者本人が負担する制度です。自由診療下で実施する免疫細胞療法は「再生医療等の安全性の確保等に関する法律(安確法)」という法律で規制されており、「安全性の確保」を重視した内容となっています。私たちNPTのビジネスモデルの前提は、がん免疫細胞療法を①保険診療で受けられる治療にすることです。それによって国民皆保険制度の庇護の下、日本国民誰もが受けられる治療を目指します。
※「再生医療等の安全性の確保等に関する法律(安確法)」とは、再生医療等の迅速かつ安全な提供等を図るため、再生医療等を提供しようとする者が講ずべき措置を明らかにするとともに、特定細胞加工物の製造の許可等の制度等を定めた法律。
薬事承認に関しては、再生医療等製品の「期限付き・条件付承認(早期承認)制度」を活用します。これは2014年にこれまでの「薬事法」が改正され「薬機法」となり、この法律の目玉が「再生医療等製品」の承認のための制度です。この制度によって、治験において必ずしも「有効性を確認」しなくとも、「有効性を推定」できれば薬事承認を受けられることになりました。再生医療を産業として日本で勃興させるために作られた制度です。
「PAPCワクチン」のような細胞等を利用した治療薬は「再生医療等製品」というものに分類されます。医薬品のような化成品とは異なり、患者自らの細胞を薬に利用するため培養や品質管理に時間を要し、大規模な治験を行うことも困難です。そのため、医薬品で要求されるフェーズⅢに相当する試験を行い、統計的有意性を得るだけの症例数を再生医療等製品の治験で集めるにはコストが掛かり過ぎます。こうした再生医療等製品の特徴に対応するために作られたのが薬機法(早期承認制度)であり、私たちの「PAPCワクチン」もこの制度を活用するために「安全性の確認」と「有効性の推定」をエンドポイントに設定した治験を行い、短期間での薬事承認を目指します。
私たちのビジネスモデルは、先ず治験を行い再生医療等製品の早期承認制度を活用し薬事承認を受けた後、保険適用の治療薬として上市し、医療現場で標準的治療として展開していきます。私たち自ら製薬会社となり自社製造・販売を行います。
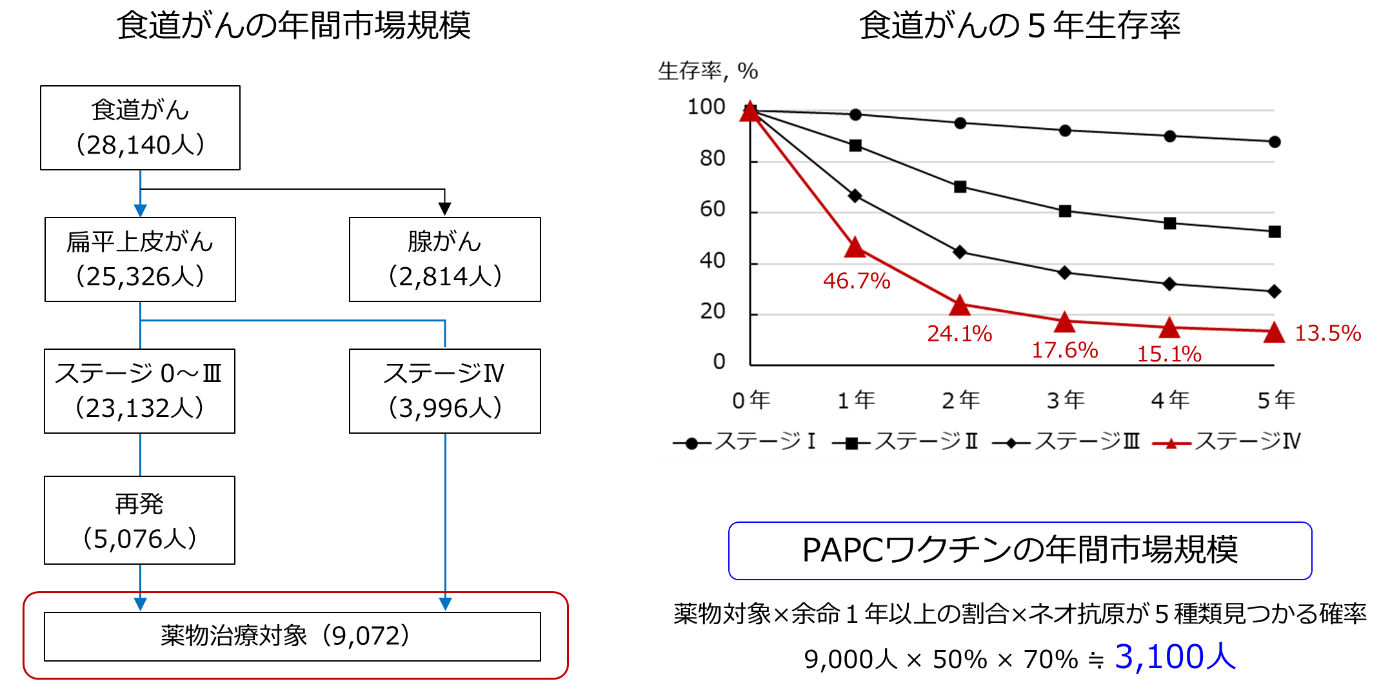 PAPCワクチンは薬物治療に該当します。食道がんの場合、薬物治療が適応となる患者数は年間で約9,000人いるとされています。他のがん種と同様に食道がんではステージⅣに近づくにつれて生存率は低下し、ステージⅣ患者における1年生存率は約5割とされています。PAPCワクチンの製造では、アフェレーシスと呼ばれる操作で大量の白血球を採取するため、比較的状態の良い患者に適していると考えています。よって、薬物治療対象者の5割前後に適応可能だと予測しています。さらに、PAPCワクチンの製造には5種類のネオ抗原を使用しますが、患者のがん細胞を解析し5種類以上のネオ抗原をもっていることを確認する必要があります。私どもが大学との共同研究において食道がん患者におけるネオ抗原探索を行ったところ、約7割の患者で5種類以上のネオ抗原が確認されました。以上の結果から、PAPCワクチンを受けていただける年間患者数は約3,100人と見積もっています。
PAPCワクチンは薬物治療に該当します。食道がんの場合、薬物治療が適応となる患者数は年間で約9,000人いるとされています。他のがん種と同様に食道がんではステージⅣに近づくにつれて生存率は低下し、ステージⅣ患者における1年生存率は約5割とされています。PAPCワクチンの製造では、アフェレーシスと呼ばれる操作で大量の白血球を採取するため、比較的状態の良い患者に適していると考えています。よって、薬物治療対象者の5割前後に適応可能だと予測しています。さらに、PAPCワクチンの製造には5種類のネオ抗原を使用しますが、患者のがん細胞を解析し5種類以上のネオ抗原をもっていることを確認する必要があります。私どもが大学との共同研究において食道がん患者におけるネオ抗原探索を行ったところ、約7割の患者で5種類以上のネオ抗原が確認されました。以上の結果から、PAPCワクチンを受けていただける年間患者数は約3,100人と見積もっています。
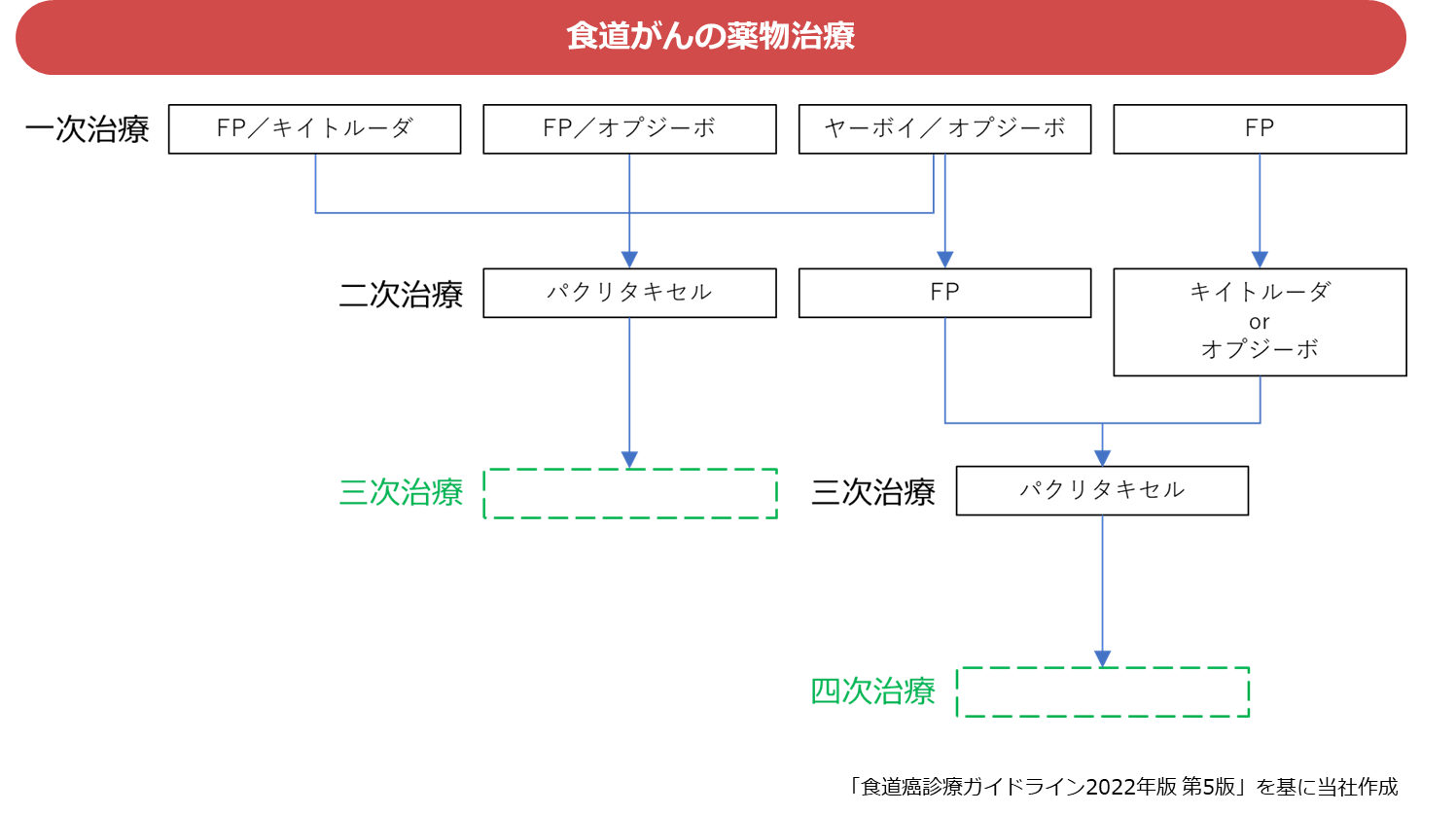
食道がんに対する標準的治療な薬物治療では、一次治療は4つの治療薬から1つが選択されます。この治療薬が効かない患者は二次治療へと進みますが、二次又は三次治療としてパクリタキセル(抗がん剤)を投与した患者に次の治療選択は残されていないのが現状です。PAPCワクチンは初めてヒトに投与される治療薬であり、このような治療薬の治験対象患者は標準的な薬物治療を終えた患者となるため、市販後は「三次又は四次治療」の位置付けとなります。
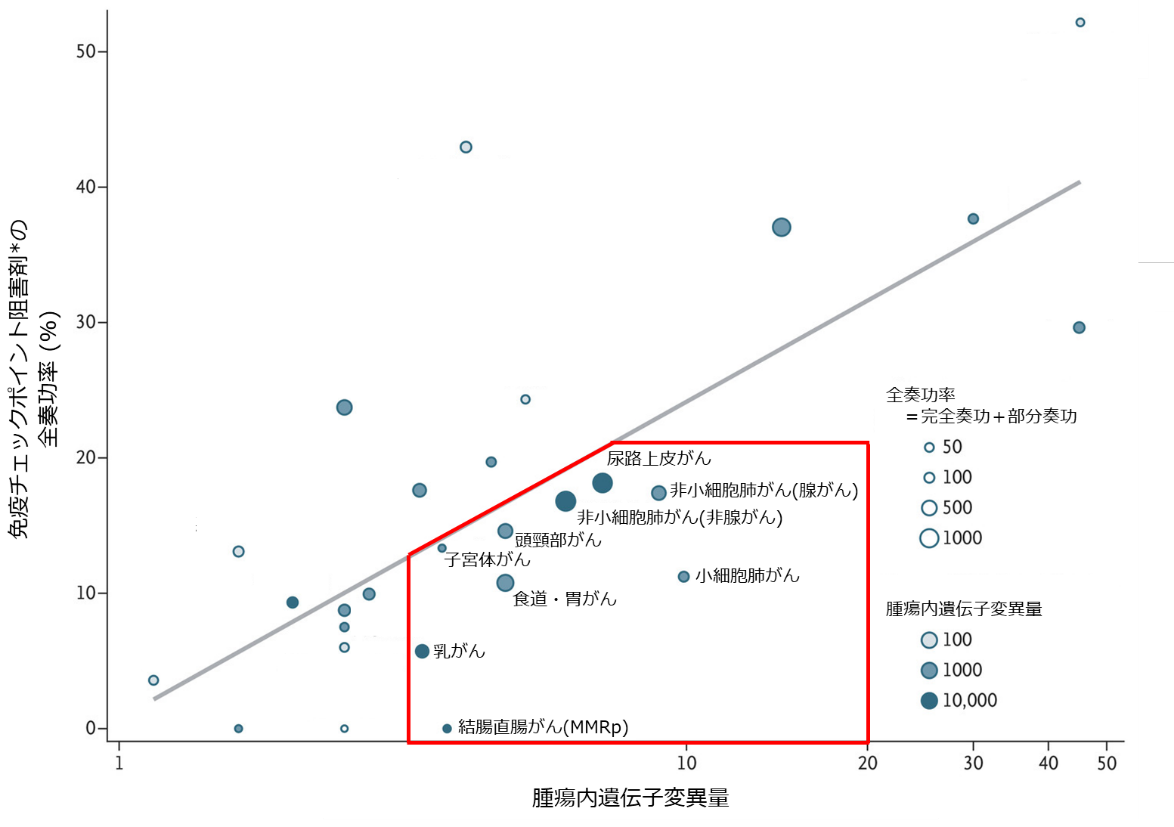
Tumor Mutational Burden and Response Rate to PD-1 Inhibition(N Engl J Med 2017) より改訂
*抗PD-1/PD-L1抗体に限る
また、PAPCワクチンの製造技術は他のがん種への適応拡大は十分に可能だと考えています。ネオ抗原は、がん細胞の変異遺伝子から作られるため「遺伝子変異量が多いがん種」で見つかりやすく、多くのがん種で適応されている「免疫チェックポイント阻害剤が効きにくいがん種」を適応可能な疾患だと考えています。現在は、PAPCワクチンに続く次世代の個別化治療薬として「胃がん」を対象としたパイプラインの研究開発も行っています。
2024年:
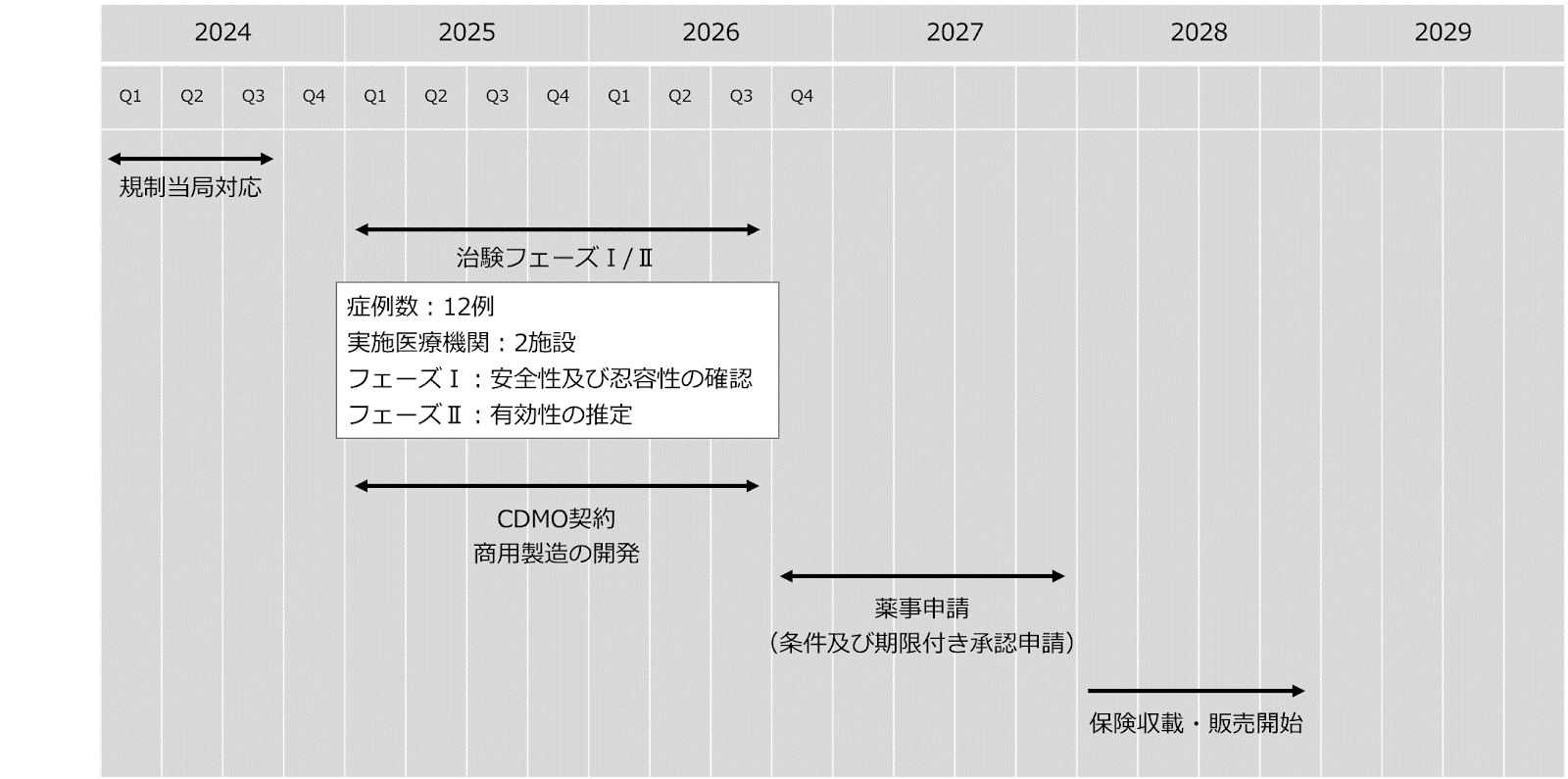
治験開始に向けた規制当局(独立行政法人医薬品医療機器総合機構)との協議を行い、治験計画届提出を行います。また、倫理委員会への提出資料及び治験実施医療機関との契約に向けた準備を進めています。
2025~2026年:
フェーズⅠでは、食道がん患者3~6名を対象にPAPCワクチンの安全性及び忍容性を評価し、臨床用量を決定します。フェーズⅡでは食道がん患者3~6名を対象に有効性(免疫学的効果及び抗腫瘍効果)の評価を行う予定です。また、販売開始に向けた商用製造の開発を治験と並行して実施し、医薬品製造販売業許可を申請します。
2026~2027年:
治験データを取りまとめ、再生医療等製品の条件及び期限付き承認制度を活用し薬事申請を行います。
2028年:
IPOに向けた準備を行いつつ、薬事承認後、治験実施医療機関を含む南関東エリアの医療機関と提携し販路を構築します。販売初年度は年間168人への提供を計画しています。
2029年以降:
販売2年目は年間1,344人への提供を計画しています。初年度同様、南関東エリアの医療機関を中心に販路を拡大するとともに、論文やセミナー、積極的なIRを通じて主要都市の医療機関への提供体制を築きます。そして、2030年(販売3年目)には売上ピークとなる3,024人への治療提供(売上高約363億円)を目指します。また、2032年には現在研究開発を進めている胃がんに対する「次世代のオーダーメイド型免疫細胞療法」の薬事承認・上市を計画しています。胃がんは食道がんに比べて市場規模が3~4倍大きく、PAPCワクチンで築いた販路を活用するので販売初年度から大きな利益が期待されます。
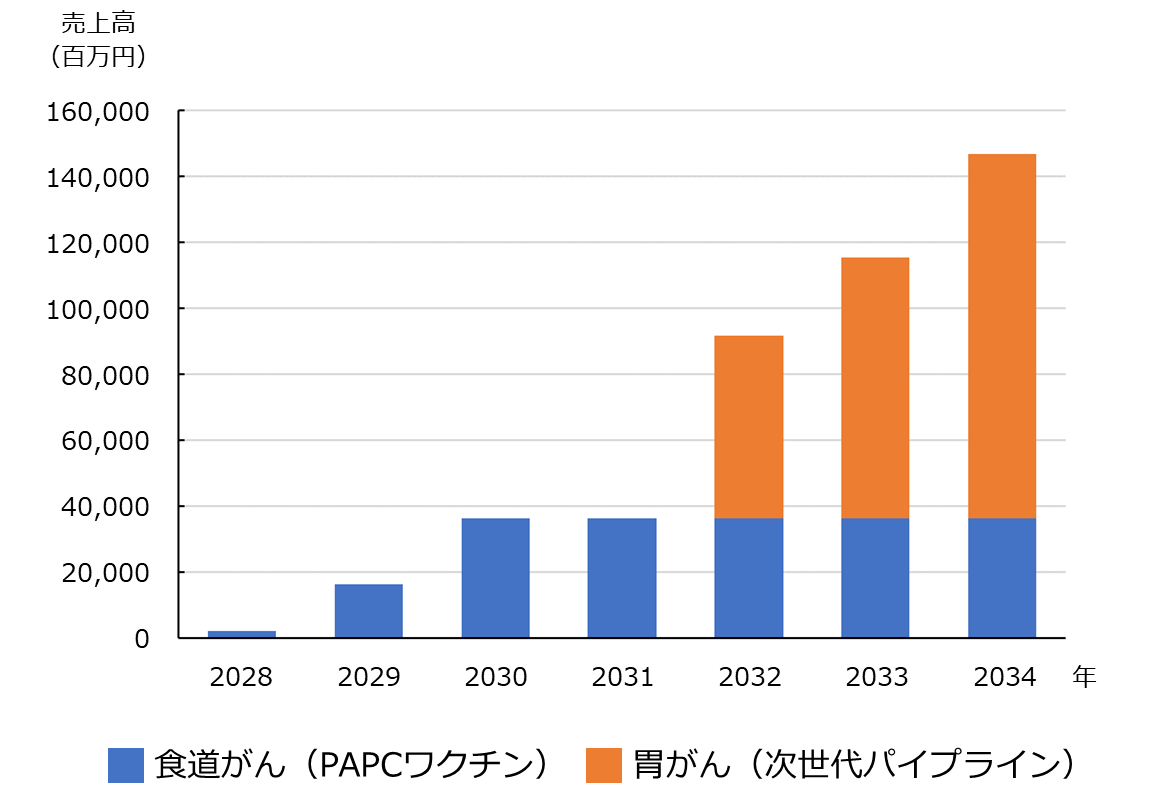
数値計画の詳細につきましては、こちらの書面をご覧ください。
新株発行概要書
代表取締役
原 健一郎
三重大学大学院生命医科学専攻終了(医学博士)。大学院から通算して約10年間がん免疫細胞療法の研究開発に従事。細胞培養士として延べ800人以上のがん患者に投与する免疫細胞を製造。これまで、ヒトパラインフルエンザ2型の樹状細胞活性化メカニズムの解明、非感染型不活性ウイルスベクターの開発及びがんに対する樹状細胞ワクチン療法の研究開発、PAPCワクチン及び腫瘍溶解性ウイルスの開発等に従事。株式会社NPTでこの知見と経験を活かし、「PAPCワクチン」の開発をリードし、細胞生産技術の開発に成功した。

取締役経営企画室長
山下 勝博
野村證券で国内支店営業、野村國際(香港)駐在、投資情報部、及び企業部にて国内外の金融及び資本市場のビジネスに従事。その後、設立メンバーとしてTSUNAMIネットワークパートナーズ株式会社(現TNPパートナーズ株式会社。取締役)の設立。株式会社TPNオンザロード代表取締役、NPO法人ベンチャー支援機構MINERVA理事を務める。

取締役CFO
大貫 篤志
公認会計士、税理士、行政書士。有限責任監査法人トーマツの後、ユビキタスAIコーポレーション株式会社、株式会社STG(監査役)、税理士法人E&M(ファウンダー、社員)、株式会社TNPパートナーズ株式会社(監査役)。

社外取締役
宮島 篤
東京大学大学院理学部研究科生物化学専攻(理学博士)。米国DNAX分子細胞生物学研究所(主任研究員、研究員、ポスドク)、(財)神奈川科学技術アカデミー(KAST)「幹細胞制御」プロジェクトリーダー、東京大学分子細胞生物研究所所長、同所特任教授、TNPスレッズオブライト株式会社顧問を務める。





100株 100,000円単位
上限募集額を発行する場合 払込金額の総額(上限募集額を発行の場合)99,000,000円のうち、発行諸費用として約16,290,000円を差し引いた後の手取概算額82,710,000円については、運転資金に72,710,000円、原料購入等に10,000,000円充当されます。
目標募集額以上、上限募集額未満の金額を発行する場合 払込金額の総額が10,000,000円(目標募集額を発行の場合)以上99,000,000円未満であった場合、差引手取概算額(7,350,000円~82,710,000円)については、運転資金及び原料購入等に調達額に応じて充当されます。
なお、事業計画は、本株式投資型クラウドファンディング、及びその他第三者割当増資等を前提にしており、状況に応じてそれぞれの資金調達金額を調整する予定です。
東京都千代田区丸の内一丁目4番5号 三菱UFJ信託銀行株式会社 証券代行部
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。また、必ずしもそのようなリスク要因に該当しない事項につきましても、重要であると考えられる事項につきましては、積極的な情報開示の観点から以下に示しております。発行会社は、これらのリスク発生の可能性を十分に認識した上で、リスクの軽減策を講じるとともに、発生した場合の対応に努める方針としていますが、本項の記載事項をご精読いただき、十分にご理解いただきたくお願い申し上げます。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。また、必ずしもそのようなリスク要因に該当しない事項につきましても、重要であると考えられる事項につきましては、積極的な情報開示の観点から以下に示しております。発行会社は、これらのリスク発生の可能性を十分に認識した上で、リスクの軽減策を講じるとともに、発生した場合の対応に努める方針としていますが、本項の記載事項をご精読いただき、十分にご理解いただきたくお願い申し上げます。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。