

日本抗体医薬株式会社
この20年で大きく進化した、がん治療。医学研究者の献身的努力によりがん発症の仕組みが分子レベルで解明、高い精度の検査法が確立され、超早期診断も可能になりました。かつては手術不可能とされた患者さんも外科的手術を受けられるようになっています。
白血病では骨髄移植も標準治療になり、重粒子線療法など新しい放射線治療も利用可能に。中でも医薬品は革命的な進化を遂げ、副作用が非常に強い化学療法と呼ばれる薬がメインであった時代から大きく変化。現在はがんに直接関係する特定の分子のみを攻撃できる分子標的薬、免疫を高めて患者さん自身ががんと戦えるようにする免疫療法※など、20年前には想像すら難しかったものが実際の医療に用いられるようになりました。
※数千万円の価格で話題になったCAR-T細胞療法や、本庶佑京都大学特別教授がノーベル賞を受賞した研究が基のPD-1抗体など
こうして、多くのがんが克服可能な病気となり、がん治療をしながら仕事を続けること、天寿を全うすることも決して珍しくない状況になりました。
しかしながら、「令和2年(2020)人口動態統計月報年計(概数)の概況」(厚生労働省)によると、日本での死亡原因として、悪性新生物<腫瘍>(がん)は昭和 56 年以降死因順位第1位を維持し、かつ割合も一貫して上昇しています。2020年では、がんはトップで27.6%、次いで心疾患15.0%、老衰9.6%となっており、全死亡者の3.6人に1人はがんで亡くなったことになります。がんであっても直接の死因として心不全や呼吸不全とされるケースもあるため、実際にはもっと多くの患者さんが実質的にはがんが原因で命を落としたものと考えられます。
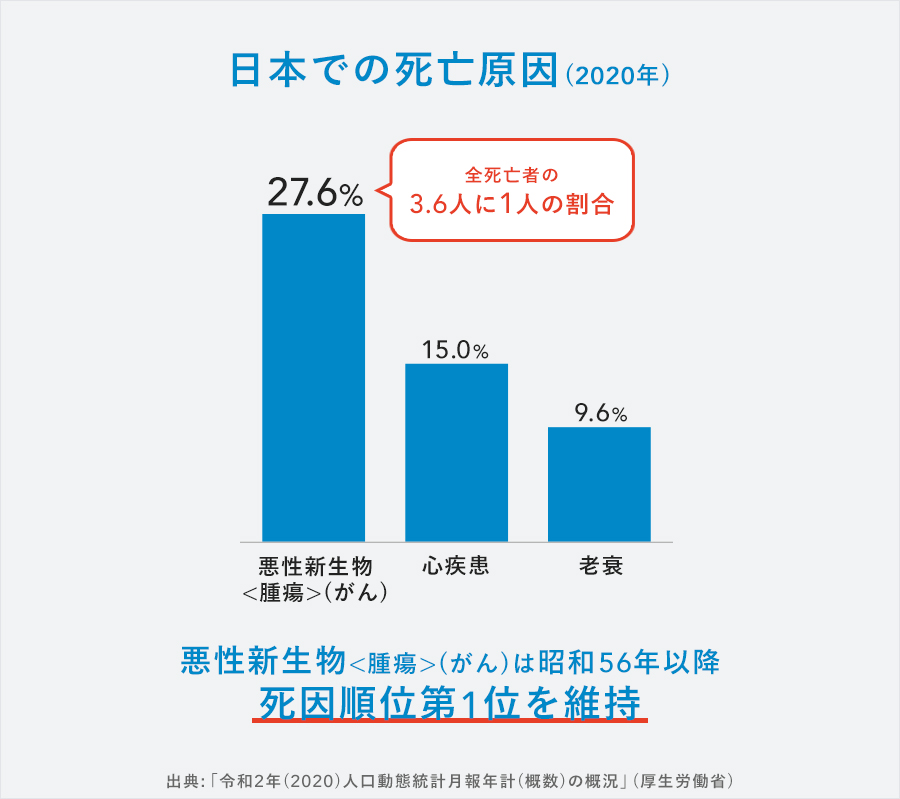
がん治療が大きく進化したのは確かですが、まだまだ多くの人のニーズがあり、革新的ながん治療開発への挑戦が求められています。
今もがん治療の第一選択肢は手術です。
様々な工夫がなされていますが、手術は麻酔や全身への大きな身体的負担、さらには術後感染の可能性もあることから、高齢者や糖尿病の患者さんなどには通常は行われません。
また、血液がん(白血病など)と呼ばれる、がん細胞がばらばらに散ばり固まりになっていない場合はそもそも手術ができません。固形がんであっても、運悪く傷を付けらない場所にできていた場合などは手術を諦めざるを得ない場合もあります。放射線治療も全てのがんに有効というわけではなく、コストや副作用などまだまだ改善すべき点が残されています。
このように手術(及び放射線治療)が難しい患者さんの多くは薬物治療を受けることになります。

化学療法剤と呼ばれる旧来の抗がん剤は、がん細胞だけでなく多くの正常細胞をも攻撃するため、非常に重い副作用が多発し、治療を断念する例がよくありました。また、多くの患者さんが耐えられるように量を調整した結果、十分な有効性を発揮できないこともありました。
最近の分子標的薬は、がん細胞に多く存在する特定の分子をターゲットとするため、正常細胞への影響を抑制できるように。旧来の抗がん剤と比べ大きく改善され、非常に期待されています。しかしながら、がん細胞だけに存在し正常細胞に存在しない分子は意外に少なく、さらにその分子が正常細胞の存在に必要なものであることもあり、副作用の問題は残されたまま。がんは様々な分子が複雑に関与しています。そのため、これまでに開発された分子標的薬では到底足りず、多様な分子ターゲットに作用する医薬品の開発が待たれています。
最近特に注目されているのが免疫療法の医薬品。患者さんのがんに対する免疫力を分子レベルで高めるよう、精密に設計されたものです。しかし、年齢や病気などにより患者さんの免疫力が大きく低下している場合は期待した効果が得られないなど、改善の余地が残されています。
他にも抗体医薬で標的分子を攻撃するタイプの医薬品もあります。これは抗体が結合した後に免疫系が働いて、標的分子が存在するがん細胞を殺傷するもの。例えば、白血病や悪性リンパ腫の治療ではイマニチブやリツキシマブなどの良い医薬品が開発され、薬物治療が比較的奏効するようになってきました。それらの新薬を核に複数の薬剤を併用し効果を高める方法が標準治療とされ、効果の面でも副作用の面でも格段に進化しています。

しかしながら、必ずしも全ての患者さんが十分な効果を得られるわけではなく、寛解(症状や徴候がほぼ消滅して正常な機能に戻った状態)を達成した後、数年以内に再発する例も時折見られます。悪性リンパ腫の治療ではR-CHOPと呼ばれる、リツキシマブ、シクロホスファミド、ドキソルビシン、ビンクリスチン、プレドニゾロンを併用する治療が高い効果を示したため標準療法になりましたが、再発率は約30%。医療現場ではまだまだ新しい医薬品が求められています。
革新的進化を遂げている医薬品であっても、まだまだ不十分な点は多く残されています。治療が効かなかったり再発してしまった場合に次の手段がないことには、患者さん、患者さんの家族、さらに医療関係者は非常に厳しい状況に追いやられます。この状況から一日も早く脱するため、様々な医薬品を開発し、次々と治療のオプションを提示できる世界の実現を目指して、私たち創薬関係者は研究開発を進めています。
当社創業者の松岡周二(順天堂大学大学医学研究科免疫診断学講座特任准教授)は、自ら開発した独自の抗体取得技術を用いて、従来の抗体にはない革新的な作用メカニズムを有する抗体医薬品候補、アナポコーシス抗体群を産生するハイブリドーマ※の樹立に成功しました。
※特定の抗体を大量に安定産生する能力を持つように細胞を融合・作製した融合細胞で、抗体製造の基本となるもの
この抗体取得技術は様々ながんの治療薬候補(抗体)を得るための極めて有力なツールで、今後も新たな作用メカニズムの抗体医薬候補の創製を目指しています。
「アナポコーシス抗体」は、当社の基盤技術により得られた全く新しい作用メカニズムを持つ抗体です。標的の異なる複数の抗体を得ており、当社ではアナポコーシス抗体群と呼んでいます。
「アナポコーシス抗体」の最大の特長は作用メカニズム。アナポコーシス抗体は標的となるがん細胞の表面に結合し、1時間以内に細胞の膜に大きな穴をあけ、がん細胞を直接的に殺傷することが確認されています。この現象を、当社はアナポコーシスと名付けました。短時間で効果を発揮するため長時間体内に滞留させる必要がなく、医薬品として開発しやすいものになっています。
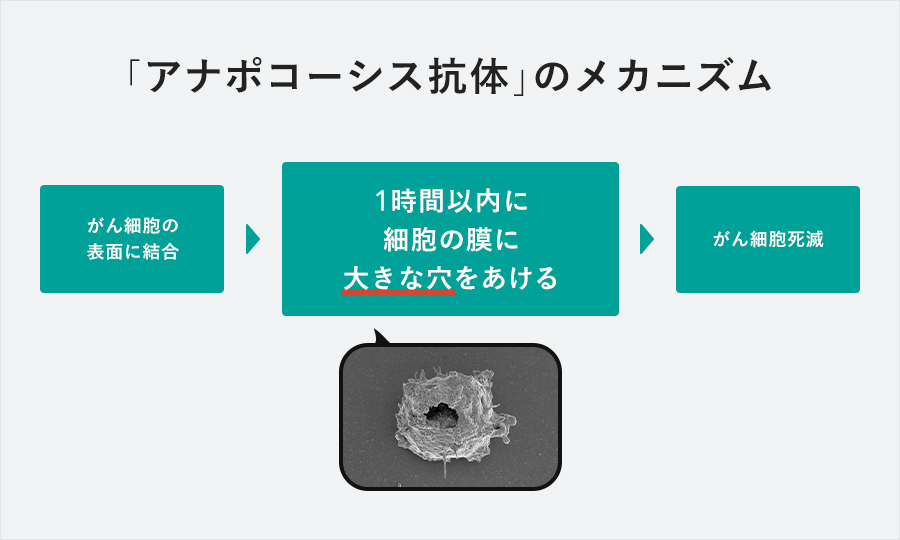
アナポコーシス抗体群では、国立研究開発法人理化学研究所(ノーベル賞受賞者の湯川秀樹博士、朝永振一郎博士、利根川進博士が在籍していた自然科学系総合研究所で、世界的に高い評価を受けている組織)との共同研究を行い、その成果について順天堂大学と理化学研究所から特許出願がなされています。当社は順天堂大学と理化学研究所から独占的実施権許諾を受け、独占的に事業化できる権利を有しています。
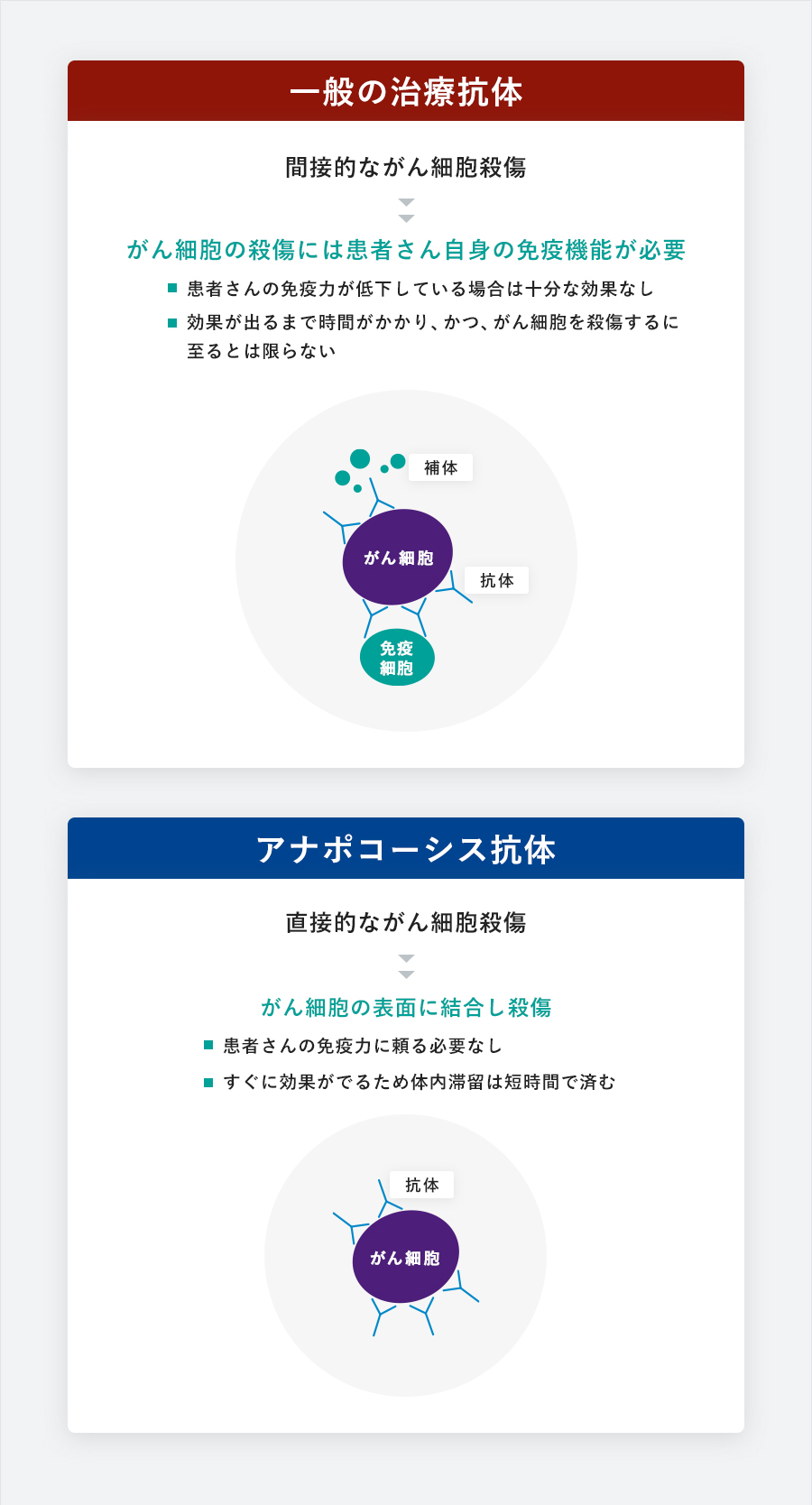
一方、一般の抗がん剤として使用されている抗体医薬は、がん細胞の標的分子に結合します。しかし結合した部位が関与する生化学的反応を阻害するだけで、細胞を殺傷するまでには至るものは稀です。殺傷するためには、患者さん自身が持つ免疫機能が適切に働き、補体反応や抗体依存性細胞傷害(何れも抗体が表面に結合した細胞に対する免疫反応で、結合した細胞を溶解させる働き)が起こることが必要です。そのため、一般の抗体医薬は間接的ながん細胞殺傷であり、患者さんの免疫機能が低下している場合は十分な効果が得られないことがあります。また、間接的であるがゆえに効果が出るまで時間がかかり、かつ、がん細胞を殺傷するに至るとは限りません。
直接的作用の「アナポコーシス抗体」はそのようなデメリットがなく、がん治療の医薬品として優位に立つものと当社は考えています。また、「アナポコーシス抗体」は、従来の抗がん剤と全く異なるメカニズムで効くため、単独で用いれるだけでなく、同時併用もできます。つまり、従来の抗がん剤のシェアを奪うのではなく、併用により市場をさらに大きく広げる可能性が高いもの。発売後の激しいシェア争いを避け、拡販活動が比較的容易になると期待できます。
「アナポコーシス抗体」の最初の開発品は「Jmab-0001」という開発コードが付けられた抗体です。

財政的に多くのがんに向けて同時に開発するのは難しいため、まず代表的な悪性リンパ腫と成人T細胞白血病をターゲットに。現行の標準治療が無効、または再発患者さんを救うことで、当社の技術の優位性を世に示します。その後、データを積み重ねて両疾患での標準治療に組み込まれるようにするとともに、他のがんにも開発を広げます。
抗体医薬は特定のターゲット分子に結合して効果を発揮します。一般的な抗体創薬のプロセスでは、まず全世界での基礎研究によって見出され公表されている病気の原因分子からターゲットを選定。そのターゲット分子を動物などに注射すると(免疫するといいます)、免疫機能により分子に対する抗体ができます。抗体を産生する細胞(B細胞)を動物から取り出し、それをもとにハイブリドーマを樹立して狙った分子に対する抗体を取得。薬効評価のためのスクリーニングシステムを用いて絞り込み、有力な抗体医薬候補を確定していきます。しかしこの場合、創薬関係者であれば誰もが知っている分子を対象とせざるを得ず、結果として厳しい競争に巻き込まれることになります。
当社の抗体取得技術は、全く異なる発想から生まれたものです。当社技術では、ヒトのがん細胞株※を直接動物に免疫。そこからハイブリドーマを樹立し、免疫したがん細胞の表面に突出している分子(細胞表面から顔を出している部分のみ)に結合する抗体医薬候補を得ます。当社の方法によれば、実際はがんに深く関与しているにもかかわらず、まだ誰も気づいていない未知の分子をターゲットにした抗体医薬を得ることも可能になります。さらに、既知の分子に結合する抗体であっても、実際にがん細胞の表面に出た立体的構造を認識して結合するより実用性の高い抗体が得られます。
※患者さんから取得したがん細胞を長期間培養(細胞分裂)。フラスコ内で半永久・安定的に増殖すると確認された状態になった細胞群を、細胞株と呼ぶ。
一般的な方法では、理論的に効果が期待できても、多くの場合実際には効果のある抗体が樹立されるのは極めて稀です。実際のがん細胞とは異なる構造を認識する抗体ができたりし、良い抗体が得られるとは限りません。

当社では「Jmab-0001」の開発と併行して、新規プロジェクトを創成。研究は順天堂大学内に設置された、順天堂大学共同研究講座(免疫診断学)において進めています。当社の基盤技術である独自抗体取得技術のブラッシュアップに加えて、現行治療ではあまり効果が期待できないがんの治療薬を中心に、次のようなプロジェクトの研究を行っています。
基盤技術を最大限活用すれば、さらに幅広い抗体医薬候補を産み出すことが可能です。将来的には上記以外のがん治療薬、診断薬の開発にもチャレンジ予定。これらの研究を進め、弊社は、大手製薬会社に劣らない充実した抗がん剤開発ポートフォリオを有するベンチャー企業として、大きな発展を目指します。
当社は、独自抗体取得技術で生み出された抗体の研究開発を自社で進め、開発の途中で製薬会社にライセンスアウトする化合物ライセンスアウト事業を事業の柱としています。将来大きな資金調達ができた場合は、低コスト・小規模な開発で当局から製造販売承認が得られる希少疾患(患者さんが少ないがん)の治療薬等を自社で開発・販売し大きな成長を遂げたいと考えています。
自社開発の途中で抗体医薬候補を製薬会社等にライセンスアウトし、開発をバトンタッチする事業。ライセンスアウト後は原則として当社は開発に関与しませんが、当社の思いが適切に引き継がれるよう、開発方針を協議するステアリングコミッティなどを設置します。
一般にライセンスアウト事業では次の体系の対価が得られます。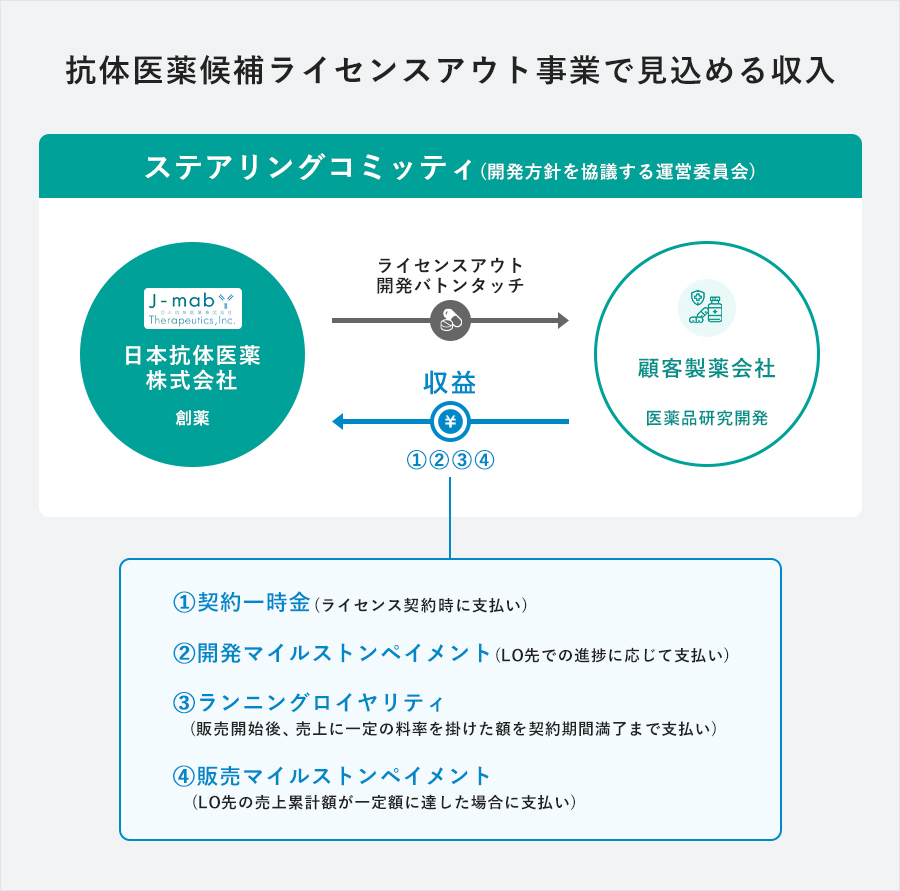
ライセンスアウトを行った時点での開発段階や想定される売上規模にもよりますが、他社事例では契約一時金、開発マイルストンペイメント及び販売マイルストンペイメントの合計額は数十億円となることが多く、100億円を超えることもあります。これに加えランニングロイヤリティを安定的に受け取れます。なお、ライセンスアウト先が開発に失敗した場合は、契約一時金のみの受け取りに終わることもあります。
一般に製薬会社は新規の抗がん剤のライセンスに強い興味を持っています。当社の最初の製品「Jmab-0001」は、革新的な抗がん剤であり、かつ併用しやすいのが特徴。そのため発売後の拡販活動も比較的容易で、他社製品と比較してもライセンスアウトの成功可能性は十分高いと考えます。
創薬ベンチャーにとって特許の実施権は大変重要です。(特許権の保有より独占的に実施できることが大切です。)当社が実施権を有する特許(出願中を含む)は現時点では下記のみですが、独自抗体取得技術のノウハウをもとにしているため、そう簡単に模倣できません。また「Jmab-0001」は、さらに改良された抗体として新しい特許が成立する可能性も十分にあり、その場合は特許保護期間が大幅に伸びます。

独自抗体取得技術で創製した抗体は、結合するがん細胞の種類、さらには同一の細胞でもどの分子に結合するか等の違いで様々な物質特許が成立すると考えられます。製剤化技術などとの組み合わせによっても特許成立の可能性があり、物質特許を中心にした幅広く強い保護が期待されます。また、順天堂大学松岡周二による新たな発明に関する特許についても、当社がその実施権の許諾を受ける予定です。
順天堂大学内に設置されている共同研究講座「免疫診断学」講座。当社が費用を負担している本講座は、基本的に共同研究として当社研究開発を促進するもの。先述の通り基盤技術のブラッシュアップ、新規抗体の取得、取得した抗体を抗体医薬候補とするためのデータ取得などが中心になっています。また、本講座を通じて大学の設備を活用でき、医学部の各診療科との共同研究も容易に。低コストで質の高い試験をすることができます。強力な特許保護の可能性と順天堂大学のバックアップは、当社の大きな強みです。
American Caner Society(アメリカがん協会)の「Global Cancer Facts & Figures 4th Edition」によれば、2018年には世界で1,700万人が新たにがんと診断され(がん患者数はこの数倍存在する)、960万人が治療の甲斐なく亡くなりました。さらに、人口の増加、特に高齢者の増加によって、2040年までに1年で2,760万人が新たにがんと診断され、1年で1,630万人ががんで亡くなると予測されています。日本でも昭和30年代から国を挙げてがん征圧のための活動がなされていますが、未だ克服には程遠い状況。国立がん研究センターの予測では2021年に約101万人が新たに診断され、約38万人ががんで亡くなるとされており、日本においてもがん患者は継続して増加しています。

上述の通り、「Jmab-0001」の開発をまず悪性リンパ腫(現行の標準治療であるR-CHOP無効または再発患者)と成人T細胞白血病の治療薬として開発します。その後患者さんでの治療実績を基に、悪性リンパ腫については「Jmab-0001」がリツキシマブ※に代わって標準治療として用いられるようになるのを目指します。
※抗がん剤・免疫抑制剤などとして使用されている分子標的治療薬のひとつ
悪性リンパ腫は大別するとホジキンリンパ腫と非ホジキンリンパ腫に分けられます。「Jmab-0001」は両者に有効と思われますが、市場規模を考慮して非ホジキンリンパ腫を対象とする予定です。(当社では、非ホジキンリンパ腫は悪性リンパ腫の90%と推定しているため。)
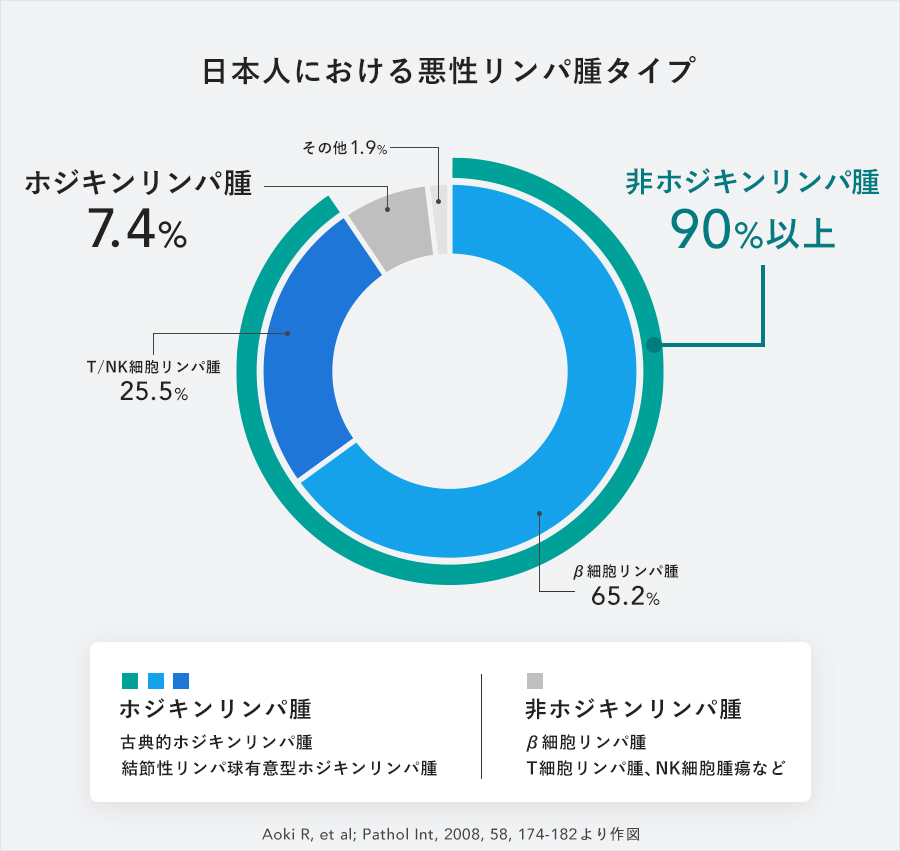
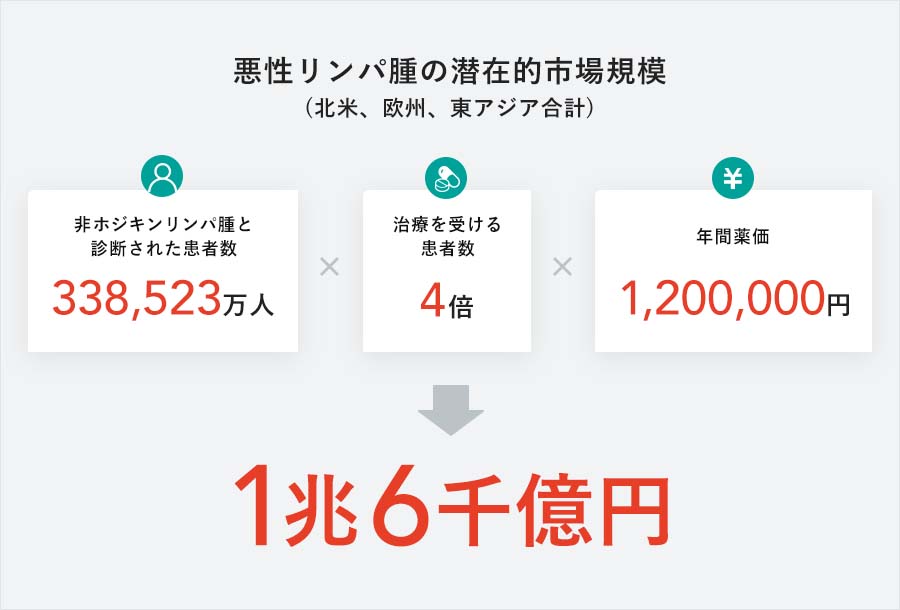
2020年12月にWHOから公表された「The Global Cancer Observatory」では、2020年は全世界で新たに544,352人が非ホジキンリンパ腫と診断され、259,753人が亡くなったとされています。また、一般に医薬品ビジネスで計画に加える地域の新しく診断された患者数は、北米:82,185人、欧州(中欧・東欧を含む):122.979人、東アジア:133,359人となっています。当社では売上予測において、これらの地域を対象としており、その新たに診断された患者数の合計は338,523人。さらに、治療が奏効して治癒される方や残念ながらお亡くなりになる方などがおられることを考えると、非ホジキンリンパ腫の治療を受ける患者数は、新たに診断される患者さんの4倍と推定しています。
潜在的市場規模につきましては、非ホジキンリンパ腫で使用する場合、「Jmab-0001」の1患者当たりの年間薬剤費(年間薬価)を120万円と予想。市場規模(全ての患者さんにJmab-0001が投与された場合の年間売上高)は、338,523人×4×1,200,000円/人=1,624,910百万円と推定されます。
「Jmab-0001」のベンチマークとなるリツキシマブ(製品名:リツキサン、ロシュ社製品)の世界売上は、2010年のピーク時で7,833百万ドル(リツキサンが対象としている他疾患での売上含む)。2020年では4,520百万ドルと売上は下降傾向にありますが、これはリツキサンの特許期間が満了し安価なバイオシミラー医薬品※にシェアを侵食されているためです。
※バイオ医薬品のジェネリック版。バイオ医薬品では全く同じものを製造することは技術的に非常に難しいので、類似品でよしとされています。
成人T細胞白血病は日本で発見された疾患で、日本(主に九州)が最も多く、カリブ、西アフリカ、イラン北東部、中央アメリカなどでも見られます。日本では、ヒトT細胞白血病ウイルス-1型(HTLV-1)に感染(母子感染によるものがほとんど)した人10万人のうち60人がいつか発症し(Cancer Science 2017 Dec;108(12):2478-2486)、海外では10万人のうち0.06人が発症するとされています(Cancer. 2020 Feb 01;126(3):567-574)。平成22年度厚生労働科学特別研究事業「ヒトT細胞白血病ウイルス-1型(HTLV-1)母子感染予防のための 保健指導の標準化に関する研究 」(研究代表者:森内浩幸 長崎大学大学院医歯薬学総合研究科教授)によれば、日本で新しく成人T細胞白血病と診断される患者は年1,000人程度。当社では成人T細胞白血病の治療を受ける患者数は、新たに診断される患者さんの2倍と推定しています。この疾患の治療薬のメインのマーケットは日本となります。
市場規模は、当成人T細胞白血病での発売が非ホジキンリンパ腫よりも先になった場合、Jmab-0001の1患者当たりの年間薬剤費(年間薬価)を136万円、非ホジキンリンパ腫よりの後になった場合は120万円と予想。全ての患者さんにJmab-0001が投与された場合の年間売上高は2,000人×1,200,000円/人~1,360,000円/人=24,000百万円~27,200百万円と推定しています。市場規模は決して大きくないですが、競合品は比較的少なく安定したシェアを確保できます。また、社会的な要請に応えるという点でも開発に十分な意義があると考えています。なお、成人T細胞白血病治療薬には現時点ではモガムリズマブ(製品名:ポテリジオ、協和発酵キリン社製品)が第一選択剤で、その売上は2020年で21億円です。
医薬品の発売までには莫大なコストと時間がかかります。うまく開発できたとしても、専門的な学術情報を伝える営業担当(MR)を多く抱える必要があり、さらに、豊富な品揃えがなければ効率が悪く十分な利益を確保できません。
そのため、当社は開発途中で製薬会社に開発と製造販売権を供与、事業化をバトンタッチするライセンスアウト型のビジネスモデルを取ります。製薬会社は豊富な開発資金を有し、効率の良い営業も可能。当社は契約時の一時金を受け取るとともに、その後も開発進捗に伴うマイルストンペイメント、発売されてからの売上に比例するランニングロイヤリティ、売上が一定額を超えた時の販売マイルストンペイメントなどを受け取ることになります。
これらの受領額は、創薬ベンチャーが開発をどこまで行っていたかで大きく変化。開発の早い段階でライセンスアウトすると低額になり、逆に発売直前となる製造販売承認まで開発を行っていた場合は高額になります。
この点、当社は患者さんでの有効性と安全性がある程度確認できる時点(業界では臨床POCが取れたと言います。)まで開発を進め、コストパフォーマンスを最大限高めたいと考えています。近年、製薬会社は自社の研究開発だけではなく、外部からのライセンスイン等を積極的に行うオープンイノベーション施策を取っています。そこで創薬ベンチャー向けの言葉としてよく聞かれるのが「臨床POCが取れているとありがたい。」や「臨床POCが取れていると社内で通しやすい。」というもの。臨床POCが取れた段階で創薬ベンチャーの受領額が一気に大きくなるのは、このような製薬会社の姿勢によるものではないかと考えています。
1つのプロジェクトのライセンスアウトに成功すれば、そこに対する開発コストはその後ほとんど発生しません。マンパワー的にも余裕ができ、対価として大きな資金を受け取れます。この獲得した資金、浮いたコスト、余裕ができたマンパワーを活用し、新たなプロジェクトの研究開発を進行。プロジェクトの研究開発進捗→ライセンスアウト成功→新プロジェクトの立ち上げ→新プロジェクトの研究開発進捗→ライセンスアウト成功→・・・この好循環をもたらすライセンスアウト戦略を取れれば安定的な会社の成長が望めます。
さらに当社は順天堂大学発ベンチャーであるメリットを最大限活用。臨床試験を大学が中心となって実施する医師主導治験として行うなど、コスト削減にも取り組みます。これらの施策により、株主様の利益をできるだけ高めるよう努めます。
創薬ベンチャーは多額の資金が必要になるため、大きな額を調達できる株式上場を目指すことが多く、当社も上場を志向しています。
東京証券取引所は、バイオベンチャーの新しいグロース市場上場に当たっての上場審査において、売上や利益は審査項目にしていません。つまり、利益が無くとも将来の期待が大きい会社は上場を許すという姿勢です。その代わり、「先行投資型バイオベンチャーの上場についての考え方と審査ポイント」を公表。その中の「事業計画の合理性」に挙げられた、下記の基準にに合致しているかどうかが審査されます。
・「典型的な医薬品開発プロセスで『臨床試験フェーズⅡaにおける薬理効果』が確認されている」
・「基盤技術を基にしたビジネスで、前臨床のパイプラインを含め、製薬会社との多数のアライアンスを通じ、基盤技術の有用性が確認されている」及び「対象患者数が多い医薬品を開発している場合に、主要なパイプラインについて、アライアンスが締結され、事業化を担保」
当社の「臨床POCが取れた段階でライセンスアウト」という戦略を実行できれば、「典型的な医薬品開発プロセスで『臨床試験フェーズⅡaにおける薬理効果』が確認されている」と「対象患者数が多い医薬品を開発している場合に、主要なパイプラインについて、アライアンスが締結され、事業化を担保」の基準を同時に満たせます。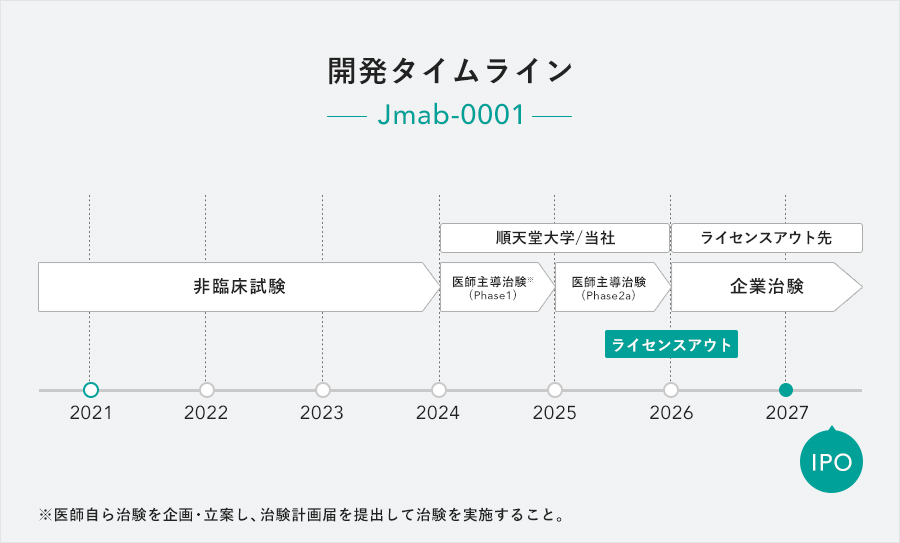
当社では「Jmab-0001」について悪性リンパ腫の臨床フェーズ2a試験を2025年末に完了し、2026年上半期に製薬会社へのライセンスアウトを計画。上場に向けた体制を構築し、速やかに上場申請を行いたいと考えています。
数値計画の詳細につきましては、こちらの書面をご覧ください。
新株発行概要書
代表取締役
岡田 嘉展
東京大学教養学部卒業後、協和発酵工業株式会社に入社MRをスタートに医薬戦略企画室長。ノーベルファーマ株式会社 事業開発部長・執行役員営業本部長。株式会社日本生物製剤 執行役員営業本部長として医薬品を中心とするヘルスケア製品の事業拡大をグローバルに行う。並行して8年前から石井保之氏、松岡周二先生とアナポコーシス抗体を用いた新薬開発を目指して様々な可能性に挑戦。創立した株式会社YAK-OHで2020年に日本抗体医薬株式会社を買収。事業戦略を再構築し、Jmab-0001の承認及び後続のパイプライン構築を目指す。

取締役
松岡 周二
東京大学医学研究科博士課程(免疫学)で多田富雄教授の教えを受けた後、サンディエゴにあるLa Jolla 免疫アレルギー研究所,石坂公成所長の元で研究員を務める。帰国後、順天堂大学の病理学講座にて病理解剖を勤めながら東大時代に始めたアナポコーシス抗体の研究を継続する。La Jolla研究所から理化学研究所に戻った石井氏とともにアナポコーシス抗体の特許を取得。現在、順天堂大学免疫診断学講座に特任准教授として勤務し、アナポコーシス抗体の研究開発をしている。

取締役
石井 保之
1988年キリンビール株式会社入社。医薬探索研究所で免疫アレルギー分野の医薬品開発に従事した後、La Jolla Instituteに留学し石坂公成博士に師事した。帰国後、通産省工業技術院/産業技術総合研究所での主任研究官を歴任した後、理化学研究所チームリーダーとしてスギ花粉症ワクチン研究に従事。その間に設立した理研発ベンチャー株式会社レグイミューンの社長/会長を歴任した後、現在に至る。
論文
・2019年
Vasculitis and crescentic glomerulonephritis in a newly established congenic mouse strain derived from ANCA-associated vasculitis-prone SCG/Kj mice. Hamano Y, Ito F, Suzuki O, Koura M, Matsuoka S, Kobayashi T, Sugitani Y, Wali N, Koyanagi A, Hino O, Suzuki S, Sugamata R, Yoshizawa H, Yumura W, Maruyama N, Kameoka Y, Noda Y, Hasegawa Y, Arai T, Suzuki K. Autoimmunity. 2019 Aug-Sep;52(5-6):208-219. doi: 10.1080/08916934.2019.1658191. Epub 2019 Sep 2. PMID: 31476889
・2016年
Biological Effects of IL-26 on T Cell-Mediated Skin Inflammation, Including Psoriasis. Itoh T, Hatano R, Komiya E, Otsuka H, Narita Y, Aune TM, Dang NH, Matsuoka S, Naito H, Tominaga M, Takamori K, Morimoto C, Ohnuma K
The Journal of investigative dermatology 139 878-889 Apr 2019
・2014年
Establishment of a Therapeutic Anti-Pan HLA-Class II Monoclonal Antibody That Directly Induces Lymphoma Cell Death via Large Pore Formation.
Matsuoka S, Ishii Y, Nakao A, Abe M, Ohtsuji N, Momose S, Jin H, Arase H, Sugimoto K, Nakauchi Y, Masutani H, Maeda M, Yagita H, Komatsu N, Hino O.
他多数
著書
・2010年 藤原書店「多田富雄さんを偲ぶ」 (岩崎敬らと共著)
・2006年 医学書院「Neurological CPC 順天堂大学脳神経内科臨床・病理カンファレンス」(水野美邦、森秀生等との共著)
・2006年 医学芸術社「最新看護学用語辞典」(山口端穂子らと共著)
・2002年 医学芸術社「臨床看護用語辞典」(山口端穂子らと共著)
掲載
・2016年 米科学雑誌プロスワン掲載
・2016年 朝日新聞デジタル&m、財経新聞等、42媒体に「アナポコーシス抗体」に関するリリース掲載
推薦
▼順天堂大学医学部 名誉教授・特任教授 アトピー疾患研究センター長 奥村康

約半世紀前に故・多田東大免疫学教授の下で、サプレッサーT細胞を発見して以来、基礎免疫学に携わっております。その続きで種々のリンパ機能分子の遺伝子(CD86,パーフォーリン等)を発見し(Nature)、その免疫制御に関わる研究を続けております。(ベルツ賞、高松宮奨励賞、安田医学賞、ISI引用最高栄誉賞、日本医師会医学賞受賞等)
日本抗体薬株式会社が開発している「Jmab-0001」は、やはり故・多田先生の門下で育った松岡周二博士(順天堂大学)が発見した抗体です。短時間で大きな穴を直接開けて癌細胞を殺傷するユニークな抗体で、その大きな穴からアナポコーシスと呼んでいます。
私が発見したパーフォリンは、キラー細胞やNK細胞から分泌される物質の一つで標的細胞に細胞膜に孔を開け破壊する作用を持っていますが、このアナポコーシスは、パーフォリンの直径で100倍もの大きな穴を開けて癌細胞を殺す非常にユニークな抗体です。
長年の研究でも見たこともないその現象は、極めてユニークで未だに解明されていない分野ですが、新たな癌治療の可能性を秘めております。正常細胞には全く反応せず、不思議なことに癌細胞には特異的な細胞死を誘導するこの抗体が、癌に苦しむ患者さんにとって大きな朗報となる可能性があると期待しています。
他に例を見ない革新的抗体技術により、日本初の抗体医薬品を製品化すること目指した、本格的な創薬ベンチャーへの成長を期待します。
日本抗体医薬株式会社が順天堂大学に共同研究講座を開設しており、それを更に発展させて癌治療薬の新たな抗体の開発とその臨床応用に向けての早い進展を期待しています。
▼熊本大学薬学部先端薬学教授 菊池正彦

わたしは熊本大学で文部科学省 地域イノベーション・エコシステム形成プログラムで行われているプロジェクト「有用植物×創薬システムインテグレーション拠点推進事業」の事業プロデューサーとして、約50人の研究者とともに天然物創薬を推進しています。
また、兼業としてライフサイエンス分野の企業コンサルティング会社を経営しています。何れも世の中の人々の健康やQOLの向上を目的とした活動を行っています。
日本抗体医薬株式会社が開発している「Jmab-0001」は、全く新しいタイプの抗がん抗体であり、がん細胞に穴をあけて細胞死をもたらすといった非常にユニークな作用を示します。
「Jmab-0001」によりもたらされるがん細胞死は、生命科学の観点からも非常に新規性が高いものであります。
従来の抗体は、それ自体でがん細胞を殺傷するのではなく、ヒトの免疫系を介したものでありました。
「Jmab-0001」は免疫系に頼らず、単独でがん細胞を殺傷する大変興味深いものです。
現状の抗がん剤は、免疫系に問題のある疾患(AIDS、進行がん、臓器移植など)にはその効果が期待できませんが、「Jmab-0001」の実用化はこの様な患者様への大きな福音となると確信します。
革新的抗体技術により、日本初の抗体医薬品を製品化すること目指した、本格的な創薬ベンチャーへの成長を期待します。
10株 100,000円単位
払込金額の総額(上限募集額を発行の場合)5,400万円のうち、発行諸費用として約1028万円を差し引いた後の手取概算額4,371万円は、開発したアナポコーシス抗体群の作用機序の解明、安全性の確認、臨床用製造原薬の準備などに充当します。
払込金額の総額が1,500万円(目標募集額を発行の場合)以上5,390万円以下であった場合、発行諸費用を除く手取概算額(1,144万円~4,362万円)は、開発費用に優先して充当する予定です。
自社による株主名簿管理となります。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。また、必ずしもそのようなリスク要因に該当しない事項につきましても、重要であると考えられる事項につきましては、積極的な情報開示の観点から以下に示しております。発行会社は、これらのリスク発生の可能性を十分に認識した上で、リスクの軽減策を講じるとともに、発生した場合の対応に努める方針としていますが、本項の記載事項をご精読いただき、十分にご理解いただきたくお願い申し上げます。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。また、必ずしもそのようなリスク要因に該当しない事項につきましても、重要であると考えられる事項につきましては、積極的な情報開示の観点から以下に示しております。発行会社は、これらのリスク発生の可能性を十分に認識した上で、リスクの軽減策を講じるとともに、発生した場合の対応に努める方針としていますが、本項の記載事項をご精読いただき、十分にご理解いただきたくお願い申し上げます。
以下において、発行会社の事業及び業績に重要な影響を及ぼす可能性がある事項を記載しております。